王春梅,李庆章
反义RNA技术作为一种阻断或封闭特定基因表达的手段,已经被广泛地研究与应用。目 前,双链RNA(doublestrandedRNA,dsRNA)介导的RNA干扰(RNA interfering ,RNAi)又成为研 究的热点。在多种生物中,外源双链RNA导入细胞中,与dsRNA同源的mRNA会被降解,导致转 录后基因沉默(post transcriptional gene silencing ,PTGS)。与此同时,研究发现在生物基因组中 广泛存在一类非编码蛋白的RNA基因,其转录物在某种机制下被加工成长度大约20~24个核 苷酸的小RNA,它们被命名为microRNA (miRNA)。其表达具有组织和时期特异性,而且其中 一些基因在进化上有很高的保守性。这类新发现的RNA具有调节其他基因表达的活性,在生 物发育过程中发挥着重要的作用。在短短的几年里,已发现大约2000多个这样的基因[1]。2002 年美国《科学》杂志评出的年度十大科技突破中,miRNA的发现名列榜首。这是RNA研究的 又一个突破,被称为RNA的第二次革命,也同时为人们提供了一种全新的角度来认识基因及 其表达调节的本质。
3.1 miRNA 的成熟
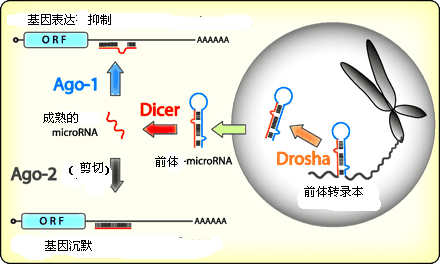
在哺乳动物 细胞内 miRNA 的成熟 : 首先 , 基因组内 作为长转录 本表达的单 一或一簇 miRNAs由polⅡ被加工成60~70nt的miRNA前体(pri-miRNA)[18-20],在核经Drosha加工成为 pre-miRNA,然后pre-miRNA运送到胞浆被Dicer酶或在胞核被CAF(Dicer酶的同族物)加工成 成熟的20~24nt miRNA[15-17](图1)。
图1 miRNA的加工成熟过程
3.2 miRNA的效应
4 miRNA的靶基因和功能
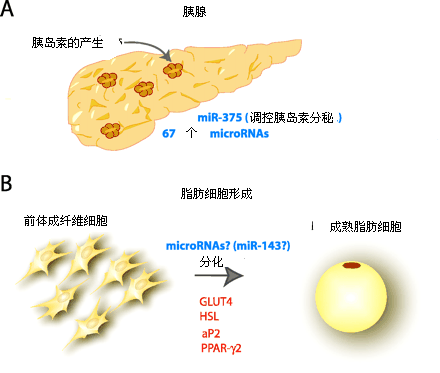
虽然现在已经找到了1000个以上miRNA,并提出它们在细胞增殖、分化、代谢与死亡中 发挥着重要的调节作用,但是至今为止,真正确认功能的miRNA还是微乎其微。Lin-4、Let-7 的靶基因是ras信号通路的蛋白[25-27];Lin-41、hbl-1、Lin-14 和lin-28调控时序发育[28];而 miR-196在哺乳动物细胞中的靶基因为HOXB8调控脊椎动物发育[29,30];miR-375在哺乳动物 中的靶基因为Mtpn对胰岛素分泌进行调节[31];miR-14的靶基因功能未知可能调控果蝇的凋 亡和脂类代谢[32];miR-181在哺乳动物的靶基因功能未知可能是调节造血系统的分化[33]; Bantam 在果蝇中靶点为Hid前凋亡基因,在发育中调节细胞增殖与凋亡[34,35]。
图2 miRNAs作用的靶细胞
Figure 2 Roles of miR-375 and miR-143
虽然在不同的时空发育阶段,它们的表达量不同,但是多种miRNA在同一个细胞中的表 达使得细胞处在一种内在的miRNA环境中,这个环境控制着成千上万的编码基因的mRNA水 平,使得各种蛋白的表达处在一个适度水平。Bartel等人[36]将这些miRNA比作微型电阻,根据 miRNA与靶基因互补的程度,执行从切割(100%抑制)到微弱抑制的不同的抑制作用。lin-4作 用于lin14和lin28,let-7作用于lin41和hbl-1起着明显的表型改变作用,在miRNA家族中是为数 较少的,更多的则是起着微调的作用。miR-7和miR-14有着多个靶基因,它们从一个整体上起 着介导某一功能的作用。由于有多个靶点,有些miRNA会有大量表达,比如miR-2在一个细胞 内有约50000个拷贝,这远多于普通mRNA的表达量。Lee等人[37]研究了通过导入某些miRNA 能够导致上 百个基因 mRNA 水平 的下 调, 虽然并不 能完全肯定 所有的这些 下调基因是 由 miRNA直接导致,但这给出了直接证据证明一个miRNA可以调控多个靶基因。另一些则是多 个miRNA作用于一个靶基因上,而最近开发的同时检测所有miRNA的表达图谱的技术[38],使 研究者能更方便地从整体上掌握特定的时空阶段miRNA产生的生物学效应。miRNA这种转 录后微调的优点如下:①比从蛋白水平的调节更节省能量;②相对于转录调节,miRNA的效果 更快而且是可逆的;③对于一些只需微量蛋白改变的现象,只有通过miRNA来达到。比如对 某种蛋白来说,1~2个mRNA拷贝就足以过量表达,这时就需要miRNA来调节控制蛋白的水 平;④内含子中编码的miRNA是一种细胞内资源的高效利用。就像前面提到的一样,miRNA 主要通过抑制它的靶基因来起调控作用,至今为止没有发现有上调能力的miRNA。
miRNA的作用遍及生命体的发生、生长、发育、分化和死亡过程。Lewis等人[39]的预测 结果发现,miRNA的靶基因多数是参与转录、信号转导、肿瘤发生的基因。虽然miRNA的作 用也是特异的,特别是5′端的2~8个碱基,特异性的靶向与它的靶基因,但是与siRNA不同的是 miRNA的特异性并不那么强,在生物体内往往一个miRNA作用于多个靶基因,如lin-4 作用于 lin14和lin28[40], let-7作用于lin41和Hbl-1[40],这就是人们提出的“多个靶点”的假说。人们也提 出可能多个miRNA调控一个靶基因[40,41]。因此,miRNA的调控作用很可能是一种调控网络, 它需要接受某些信号的刺激,从整体上调控有机体的生命活动。
目前miRNA 的研究现在还处在理论水平上, 讨论关于miRNA 的应用还为时过早。但 miRNA作为体内正常表达的基因,与生命活动的关系,还有待进一步研究。以miRNA为靶点 研究生命活动或者以miRNA为治疗手段的设想[43],以后可能会成为焦点。而Calin等人[43]报道的miRNA基因芯片技术也很可能成为肿瘤诊断的工具。Suh等人[44]报道,在人胚胎干细胞中表达的miRNA与其他细胞类型的miRNA有很大的不同,miRNA作为人器官定向分化的调节 子,为以后人器官体外培植带来促进作用。miRNA作用和功能的揭示必定给miRNA带来广阔 应用的前景。
5 展望
自从在四膜虫中发现核酶以来,引起了整个生物学界对RNA及其作用的关注,也让人们 就生命起源的问题争论了十几年。在人们对生命由RNA起源的争论降温时,1998年Fire等人报 道在线虫中发现了RNAi,重新又将人们的视线转到RNA上来。RNAi是一个强大而特异的基 因沉默机制,可成为研究基因功能[44]和疾病治疗[45]的有用工具,这是生物研究领域的一个突 破性研究成果。miRNA研究的飞速发展也得益于RNAi的发现。但与此不同的是,miRNA是生 物体内源的小RNA分子,研究表明它们在生物体内不仅仅是代谢产物,而且还是机体有目的 编码的重要的调控分子。它们参与生物体的生长、发育、衰老、死亡的调控。随着研究的深 入,miRNA 将在生命起源和物种进化、基因表达调控的复杂性、疾病发生和发展的机制等方 面起到更为深远的作用。同时,miRNA的研究亦将为RNAi技术的应用提供新的依据、思路和 空间。现在,欧美等发达国家已将有关miRNA的研究广泛而深入地运用到组织器官的定向发 育、细胞生长分化的时空调节、信号通路的开启和关闭、细胞周期的监测与调控、学习与记 忆、肿瘤的逆分化、肥胖、衰老和死亡,疾病的防治以及有目的的基因表达调控上。
寻找调控的miRNA基因以及miRNA的靶基因,揭示miRNA具体的作用机制是非常重要 的。就目前的研究来看,虽然在各个物种中发现的miRNA数量不少,但是能给出直接证据证明 miRNA的靶基因及其功能的miRNA很少,而且多数是通过筛选突变子获得的,这说明现在寻 找miRNA基因的研究与其功能的研究是脱节的,现在摆在科学家们面前的两大问题是:在各 种生物中找齐这些miRNA和发现它们的靶基因并揭示它们的功能,这也可以说是后基因组时 代需要解决的问题之一[46]。由于miRNA 基因对于生物的生长、发育和分化非常重要,而且具 有特异的时空表达的特点,那么全部miRNA基因及其功能的揭示可能将会给人们对生命现象 的认识带来一场新的革命。
参考文献
[1]Yong Kong ,MicroRNA: Biological and Computational Perspective Geno. Prot. Bioinfo. 2005, 3 ( 2):62~72 [2] Lee R C ,Feinbaum R L ,Ambros V. The C. elegans heterochronic gene li n - 4 encodes small RNAs with antisense complementarity to lin-14 RNA. Cell ,1993 ,75 :843~854.
[3]Wightman B , Ha I , Ruvkun G. Posttranscriptional regulation of the heterochronic gene lin - 4 by lin - 4 mediates temporal pattern formation in C. elegans . Cell ,1993 ,75 :855~862.
[4 ] Moss E G,Lee R C ,Ambros V. The cold shock domain protein L IN - 28 controls developmental timing in C. elegans and is regu-lated by lin - 4 RNA. Cell ,1997 ,88 :637~646.
[5] Reinhart B J , Slack F J , Basson M , et al . The nucleotide let-7 RNA regulates evelopmental timing in Caenorhabditis elegans .Nature , 2000 , 403 (6772) : 901~906
[6] Baulcombe D. DNA events : an RNA microcosm. Science , 2002 ,297 (5589) : 2002~2003
[7] Ruvkun G. Molecular biology glimpses of a tiny RNA world.Science , 2001 , 294 (5543) :797~799
[8] Lagos-Quintata M , Rauhut R , Lendeckel W, et al . Identification of novel genes coding for small expressed RNAs. Science , 2001 ,294 (5543) : 853~858
[9] Lau N C , Lim L P , Weinstein E G, et al . An abundant class of tiny RNAs with probable regulatory roles in
Caenorhabditis elegans. Science , 2001 , 294 (5543) : 858~862
[10] Lee R C , Ambro V. An extensive class of small RNAs in Caenorhabditis elegans. Science , 2001 , 294 (5543) : 862~864
[11] Reinhart B J , Weinstein E G, Rhoades M W, et al . MicroRNAs in plants. Genes & Dev , 2002 , 16 (13) :1616~1626
[12] McManus M T , Sharp P A. Gene silencing in mammals by small interfering RNAs. Nature Reviews Genetics , 2002 , 3 (10) : 737~747
[13] Sempere L F, Freemantle S, Pitha-Rowe I, et al. Expression profiling of mammalian microRNAs uncovers a subset of brain-expressed microRNAs with possible roles in murine and human neuronal differentiation. Genome Biol, 2004, 5(3): R13
[14]. Pasquinelli, A.E., et al. Conservation of the se-quence and temporal expression of let-7 heterochronicregulatory RNA. Nature2000. 408: 86-89.
[15.] Zeng, Y., et al. Recognition and cleavage of pri-mary microRNA precursors by the nuclear processing enzyme Drosha. Embo J. 2005. 24: 138-148.
[16] Zeng, Y. and Cullen, B.R.. Structural require-ments for pre-microRNA binding and nuclear export by Exportin 5. Nucleic Acids Res. 2004 32: 4776-4785.
[17]. Park, M.Y., et al.. Nuclear processing and ex-port of microRNAs in Arabidopsis. Proc. Natl. Acad. Sci. USA 2005102: 3691-3696.
[18] Kim, V.N. MicroRNA biogenesis: coordinated cropping and dicing. Nat. Rev. Mol. Cell Biol. 2005. 6:376-385.
[19] Lee, Y., et al. MicroRNA genes are transcribed by RNA polymerase II. Embo J. 2004. 23: 4051-4060. [20]. Cai, X., et al.. Human microRNAs are processed from capped, polyadenylated ranscripts that can also function as mRNAs. RNA 200410: 1957-1966.
[21]. Okamura, K., et al. Distinct roles for Argonaute proteins in small RNA-directed RNA cleavage path-ways. Genes Dev. 2004. 18: 1655-1666.
[22] Tang, G. siRNA and miRNA: an insight into RISCs. Trends Biochem. Sci. 2005. 30: 06-114.
[23] Zeng Y, Cullen B R. Structural requirements for pre-microRNAbinding and nuclear export by Exportin 5. Nucleic Acids Res,2004, 32(16): 4776~4785
[24]Hutvágner G, Zamore P D. A microRNA in a multiple-turnover RNAi enzyme complex. Science, 2002, 297: 2056~2060
[25] David P B. MicroRNAs: Genomics, biogenesis, mechanism, and function. Cell, 2004, 116: 281~297
[26] Bartel D P, Chen C Z. Micromanagers of gene expression: The potentially widespread influence of metazoan microRNAs. Nat Rev Genet, 2004, 5(5): 396~400
[27] He L, Hannon G J. MicroRNAs: Small RNAs with a big role in gene regulation. Nat Rev Genet, 2004, 5(7): 522~531
[28] Lagos-Quintana M, Rauhut R, Meyer J, et al. New microRNAs from mouse and human. RNA, 2003, 9:175~179
[29] Mansfield J H, Harfe B D, Nissen R, et al. MicroRNA-responsive ‘sensor’ transgenes uncover Hox-like and other developmentally regulated patterns of vertebrate microRNA expression. Nat Genet,2004, 36(10): 1079~83.
[30] Yekta S, Shih I H, Bartel D P. MicroRNA-directed cleavage of HOXB8 mRNA. Science, 2004, 304(5670):594~596
[31] Poy M N, Eliasson L, Krutzfeldt J, et al. A pancreatic islet-specific microRNA regulates insulin secretion. Nature, 2004,432: 226~230
[32]Xu P, Vernooy S Y, Guo M, et al. The Drosophila microRNA mir-14 suppresses cell death and is required for normal fat metabolism.Curr Biol, 2003, 13: 790~795
[33] Chen C Z, Li L, Lodish H F, et al. MicroRNAs modulate hematopoietic lineage differentiation. Science, 2004,303: 83~86
[34] Hipfner D R, Weigmann K, Cohen S M. The bantam gene regulates Drosophila growth. Genetics, 2002, 161:1527~1537
[35] Brennecke J, Hipfner D R, Stark A, et al. bantam encodes a developmentally regulated microRNA that controls cell proliferation and regulates the proapoptotic gene hid in Drosophila. Cell, 2003,113: 25~36
[36] Bartel D P, Chen C Z. Micromanagers of gene expression: The potentially widespread influence of metazoan microRNAs. Nat Rev Genet, 2004, 5(5): 396~400
[37] Lim L P, Lau N C, Garrett-Engele P, et al. Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs. Nature, 2005, 433: 769~773
[38] Nelson P T, Baldwin D A, Scearce L M, et al. Microarray-based,high-throughput gene expression profiling of microRNAs. NatMethods, 2004, 1: 155~161
[39] Lewis B P, Shih I, Jones-Rhoades M W, et al. Prediction of mammalian microRNA targets. Cell, 2003, 115:787~798
[40] Reinhart B J, Slack F J, Basson M, et al. The 21 nucleotide let-7RNA regulates developmental timing in Caenorhabditis elegans.Nature, 2000, 403: 901~906
[41] Ambros V. The functions of animal microRNAs. Nature, 2004,431(7006): 350~355
[42] Takamizawa J, Konishi H, Yanagisawa K, et al. Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival. Cancer Res, 2004,
[43] Calin G A, Liu C G, Sevignani C, et al. MicroRNA profiling reveals distinct signatures in B cell chronic lymphocytic leukemias.Proc Natl Acad Sci USA, 2004, 101(32): 11755~11760
[44] Suh M R, Lee Y, Kim J Y, et al. Human embryonic stem cells express a unique set of microRNAs. Dev Biol,
2004, 270(2):488~498
[45] 徐颖, 朱成钢, 金勇丰, 等. dsRNA 对家蚕核多角体病毒(BmNPV)复制的抑制作用. 科学通报, 2004,49(11): 1073~1078
[46]陈 芳 殷勤伟 调控基因表达的miRNA 科学通报 第50 卷 第13 期 2005 年7