生物大分子的三维结构与功能的关系是分子生物学前沿分支——结构分子生物学的核心内容。基于物理化学原理的方法和技术所获得的生物大分子(如蛋白质)结构信息是彼此互为补充的。通过直接测定蛋白质氨基酸序列,或测定转录蛋白质的基因或cDNA的核苷酸序列可得到蛋白质的一级结构;用荧光光谱、紫外吸收光谱和近紫外圆二色光谱分析等可以测定蛋白质分子中芳香族残基所处的局部环境;用远紫外圆二色光谱或傅立叶变换红外光谱可以测定蛋白质中各种不同的二级结构。就空间结构测定而言,主要是用X射线晶体学方法和核磁共振技术,也有人用电镜三维重组、电子衍射、中子衍射和各种频谱学方法,其中X射线晶体学方法是最有效的、有时也是唯一的手段。
1、 X射线衍射结构分析
显微镜技术的进步使生物学进入细胞水平,而X射线衍射技术则使生物学深入到分子和原子水平。X射线衍射分析利用X射线的波长与原子的大小及原子间距同数量级这一特征,当一束准直的X射线入射到样品晶体分子时,组成分子的原子使散射的X射线相互干涉形成衍射图形。衍射点的位置和强度取决于分子中原子的排列和相互关系。很多生物大分子样品都可以制成晶体样品,因而衍射图形能够提供有关分子结构的信息。晶体内部存在重复排列,晶体结构的特征是组成晶体的粒子(原子、离子或分子)的排列具有周期性和对称性。晶体可以看成是由晶胞(或者晶格)堆积而成的。晶胞三个棱的长度a、b、c称为晶胞常数。也可以把晶体看成是由一组平行、等距、结构相同的原子面(即晶面族)组成。晶面族的取向可以用密勒指数表示。
X射线衍射方向决定于晶体的周期或晶面间隔,但是,在周期相同或晶面间隔相同的情况下,由于晶胞内原子排布方式不同,则会造成衍射点强度不同。也就是说,衍射点强度的大小包含着与分子结构有关的信息。分子结构中所有原子对每一个衍射斑点的强度都有各自的贡献,因此,通过分析X射线衍射点的强度,可以得到有关晶胞内原子排布的信息。
常用的晶体衍射强度的记录有两种方式。一种是将晶体所产生的衍射光束点记录在底片上,如经典的感光胶片,然后,用扫描仪阅读衍射强度。近年来发展起来的象板探测器,实际上是用象板取代了感光胶片,免除了显影、定影等麻烦。另一种方法是多丝正比面探测器,先将衍射光束光子信号转换为电子信号,再处理为衍射强度。还可以采用CCD技术,使数据采集精度和信号转换速度得到较大的提高。这非常重要,因为生物大分子晶体结构解析的分辨率和精度主要取决于晶体衍射数据采集的质量和精度。
多波长反常散射法成为近年来发展较快的一种方法。生物大分子中通常含有金属离子或重原子,不同的原子对不同波长的X射线具有特征的反常散射效应。同步辐射光源具有强度高、单色性好、波长连续可调的特点,在进行生物大分子晶体衍射实验时,如果晶体中含有金属离子或重原子,则可以将同步辐射光源的波长调整到对应原子反常散射明显的位置,获得反常散射数据,从而进行晶体结构的解析。
生物大分子的二级结构常常是螺旋结构(如蛋白质中的a螺旋和DNA的双螺旋),其特点是每一圈螺旋中(即每一周期)包含一定数量的、散射能力相同的结构单元。具有螺旋结构的生物大分子,其X射线衍射图有相应的特点。凡是衍射图上具有这些特点的物质,如纤维状蛋白质、DNA,其结构均为螺旋结构。
利用从衍射图得到的衍射数据,可以分析出晶胞内三维空间的电子密度分布,确定结构模型。下面以肌红蛋白为例加以说明。肌红蛋白分子量为18000,含有153个氨基酸残基,分子中有1200个原子(不包括氢原子)。为了定出分子中所有原子的位置,需要测量大约20000个衍射点的强度并计算其位相角。第一阶段分析到6Å的水平,定出多肽链和正铁血红素的位置,其中棒状结构符合a-螺旋的特征,推算出a-螺旋约占残基总数的70%。进一步分析提高到2Å的水平,虽然不能定出每个原子的位置,但可以肯定分子的主要部分是由a-螺旋组成,而且是右手螺旋,链必须弯曲、盘绕。其中大约13~18个残基不是a-螺旋,一半以上的氨基酸残基能定出种类。再进一步分析到1.5Å的水平,可以完全弄清楚氨基酸排列顺序。这样,通过X射线衍射的研究,可以确定蛋白质一级、二级、三级结构。可见X射线衍射分析是研究生物大分子结构的强有力的工具。
用X射线衍射技术分析分子结构时,一般有以下几个步骤:(1)用实验测定单个晶格的线度和从衍射图中测量衍射点的强度;(2)根据上述数据,结合其它方法推断原子排列,得到尝试结构模型,计算这种结构的衍射极大值,然后与实验观察值比较;(3)修正所提出的模型,直到计算结果和实际所得到的数据趋于吻合。
X射线晶体学方法是测定蛋白质结构的主要方法。球状蛋白质是多肽链卷曲成团的蛋白质,它和纤维状蛋白不同,构型一般比较复杂。球状蛋白质分子量大,表面基团的构象不稳定,要获得有序排列的晶体是比较困难的。所形成的晶体不可能是完美的堆砌,而是会在分子之间形成许多大的孔或通道。这些通道常常由占晶体体积一半以上的溶剂分子所占有,而溶剂分子的绝大部分在晶体上又是无序的。晶体中的蛋白质分子之间仅有少量的区域发生接触,这些区域的相互作用也是较弱的相互作用,通常是通过一个或几个溶剂分子发生作用。蛋白质晶体的形成依赖于一些参数,如pH值、温度、蛋白浓度、溶剂的种类、沉淀剂的种类以及金属离子和某些蛋白的配基等。
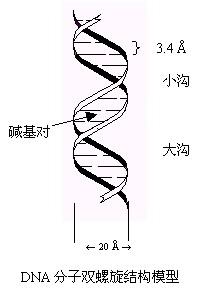
用X射线衍射图分析DNA的空间结构,出现螺旋结构的衍射图样,说明每一圈螺旋有10个重复结构单元,反映了分子间的排列情况。根据DNA的X射线衍射图结合其它技术,Watson和Crick提出了DNA的空间结构模型:两条多核苷酸链组成反平行的右手双螺旋,磷酸在外,碱基在内;螺距为34Å,每圈螺旋包含10个核苷酸,每个核苷酸轴长为3.4Å,螺旋直径为20Å;两条链之间形成氢键(如图)。
2、核磁共振结构分析
进行晶体衍射结构分析的先决条件是获得高质量的、可供衍射分析用的晶体,但有时要得到合适的晶体是非常困难的;另外,由于蛋白质通常是在水溶液中发挥其生物功能,而蛋白质在晶体和溶液状态下的结构可能是不同的。如何在溶液中测定蛋白质的空间结构,一直是人们所关注的问题。近年来,迅速发展的核磁共振技术(NMR)为在溶液环境中测定蛋白质结构提供了可能。另一方面,蛋白质结构在生物系统中是不断变化的,认识蛋白质结构的动态特性对于了解生命过程是非常重要的。利用NMR技术可以研究蛋白质结构的动态特性。
核磁共振现象是1946年由美国斯坦福大学的Bloch和哈佛大学的Purcell研究小组发现的。核磁共振波谱法是利用原子核的物理性质,采用当代最先进的电子学和计算机技术,研究各种分子化学结构的一种有效工具。核磁共振技术在生物化学领域有重要的应用,这种技术可以在不破坏生物样品并保持在溶液状态下研究生物大分子,例如分析蛋白质结构的动态变化,研究分子结构与生物功能的关系。近年来,多维核磁共振技术迅速发展,已成为结构生物学中除X射线晶体衍射方法外最重要的实验技术。
核磁共振技术在分子生物学中的主要应用包括:(1)测定生物大分子的空间结构,研究生物大分子与配基的相互作用;(2)测定生物大分子的动力学性质;(3)跟踪蛋白质的折叠过程,捕获折叠过程中瞬态的中间物。
核磁共振是指原子核吸收外界能量而产生的一种能级跃迁现象,这种能级跃迁实质上是共振吸收(或刺激吸收)。共振吸收的特点是:通过外界能量激励电磁场,其磁矢量在某一平面内旋转。产生核磁共振的条件是,当激励磁场的磁矢量旋转圆频率等于原子核的运动频率且方向一致时,原子核才会吸收能量,产生能级跃迁。
NMR谱一般是由多条形状不同、间距和高度也不同的吸收线组成的。谱线给出了丰富的信息,关键在于如何识别谱线,将信息解译出来。谱线相对基准线的位置,叫做化学位移,它与某种特定基团在谱线中的位置有关。谱线下所围成的面积,代表谱线强度,它与吸收的等效核数成正比。谱线形状、宽度和数目,与弛豫时间、自旋—自旋分裂有关。谱线强度用谱线下所围的面积表示。由于谱线不只是一条,所以通常用若干条谱线积分面积之比表示。例如,甲醇的NMR谱中,谱线积分面积之比为1:3,它代表了自旋核的相对数值。在邻近核上存在自旋,可引起共振谱线的分裂(自旋—自旋分裂),其表现在NMR谱中的每条吸收线分裂为若干条线(有的吸收线不分裂)。
NMR利用核磁共振(NMR)谱的分析可得到如下生物材料结构与功能关系信息:共振谱线的位置是所属化学基团的标志;谱线面积正比于产生共振的核的数目;谱线的细微分裂(谱线的多重性)及其相对强度,反映出共振核的近邻环境;谱线宽度则与分子迁移率、分子刚度及自旋—自旋弛豫和晶格—晶格弛豫等有关。弛豫是一个系统受到扰动失去平衡后恢复到平衡状态的过程。自旋—自旋弛豫是自旋系统恢复到平衡态的过程。利用核磁共振技术研究生物材料的优点是:能研究溶液和活体中生物分子的构象及其变化,了解动态过程。这对研究组成生物体的主要元素氢、碳、氮、氧等轻元素特别有效。通过研究共振谱随温度的变化,能辨别生物大分子中发生变构的部分。例如,具有输送 O2、CO2重要功能的血红蛋白,在氧合和非氧合状态的核磁共振谱不同:非氧合状态具有相当于6个H+强度的特征谱线,在氧合状态却消失了。这反映了两种状态具有不同空间卷曲的三维结构。生命现象是复杂多变的,生物大分子在溶液态的多变结构与生命活动紧密相关。NMR新技术的发展,开辟了测试并解析高分子量蛋白质、核酸、糖类等生命物质的新天地。
在分析生物大分子结构的动态特性方面,激光拉曼光谱和蛋白质荧光光谱也有着应用。可以用激光拉曼光谱检测生物分子的振动运动,用蛋白质紫外荧光猝灭方法研究蛋白质分子的涨落运动。
在实际应用中,究竟用X射线晶体衍射分析,还是用NMR技术,需要根据具体情况而定。对于蛋白质结构测定而言,进行X射线晶体衍射分析要求事先将蛋白质结晶,而这并非是一件容易的事。NMR虽然可以在溶液状态中检测而不要求结晶,但目前只能分析较小的蛋白质。所以,根据待测蛋白质的情况灵活采用不同分析技术,才能快速、有效地得到所需要的分析结果。


