刘万飞 王西亮 赵宇慧 曾瀞瑶 耿佳宁 胡松年
中国科学院北京基因组研究所
摘要:
随着基于第二代测序技术的细菌基因组与转录组研究越来越广泛,选择合适的研究策略变得越来越重要。就基于第二代测序技术的细菌基因组和转录组研究策略进行综述,并简要介绍细菌基因组和转录组研究中的机遇和挑战。综述细菌基因组与转录组研究的常规方法及步骤,并简要地介绍存在的问题。细菌基因组和转录组研究策略为大多数细菌的研究提供了一个相对完整的研究路线,同时也会促进其它领域的研究,如生命形成、生物进化、基础代谢、疾病、药物等。
Recently, many bacterial genome and transcriptome studies have been performed based on the next-generation sequencing technologies. Therefore, how to select the appropriate research strate- gies is becoming increasingly important. In this paper, we discussed the research strategies of bacterial genome and transcriptome based on the next-generation sequencing technologies, and stated the opportunities and challenges in these fields briefly. We reviewed the conventional methods and procedures and presented the existing problems briefly for bacterial genome and transcriptome studies. The re- search strategies of bacterial genome and transcriptome provide a relatively complete pipeline for the majority of bacteria. Moreover, it will promote the research of other fields, such as the course of life, biological evolution, basal metabolism, disease and drugs.
伴随着我国1%人类基因组计划的完成,基因组学及转录组学在我国取得了快速发展。以454、Solexa和SOLiD为代表的第二代测序技术的出现,更使大规模应用基因组及转录组方法解决科学问题成为可能。与此同时,遗传学的研究对象由少量基因及其功能转变为生物体的全基因组结构、基因功能、表观修饰、细胞调控等,遗传学研究进入了基因组和后基因组时代。其中,通过细菌基因组和转录组研究来揭示生命基本过程,如生命形成、生物进化、基础代谢、疾病发生、药物靶点等,成为生物学研究的重要手段。目前,以高通量低成本为特点的第二代测序技术使得单个实验室或者研究组独立进行细菌基因组及转录组研究成为可能。然而,如何将海量测序结果组装成一个完整的细菌基因组,以及如何将RNA测序结果还原成细菌特定生理状态下的转录情况是科学家面临的主要问题。本文对现阶段基于第二代测序技术的细菌基因组及转录组研究策略进行综述,旨在为细菌基因组及转录组研究提供帮助。
1 细菌基因组学研究
1.1 细菌基因组学简介
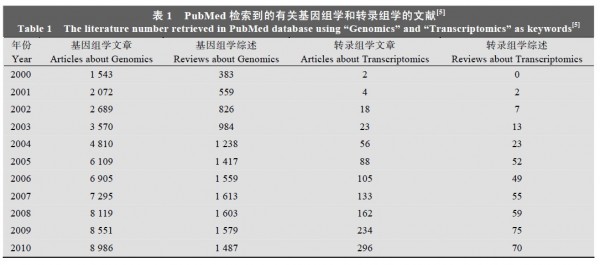
细菌基因组学是研究细菌全基因组 DNA 序列及其结构与功能的学科。1995 年, 科学家获得了流 感嗜血杆菌(Haemophilus influenzae Rd)的全基因组序列 [1], 这是第一个 完整 的基因 组序 列 , 也是 第 一个完成的细菌基因组序列。紧接着古细菌詹氏甲烷 球菌(Methanococcus jannaschii)基因组[2]、大肠杆菌(Escherichia coli K-12)基因组[3]等也相继完成。细菌 基因组研究 不仅有利于 研究细菌的 基本生命过 程 ,同时也对高等真核生物的基因组学及后基因组学研究提供了参考和平台。到目前为止, NCBI 上记录了1534 个细菌基因组, 包括了 103 个古细菌和 1431个真细菌(2011-4-24)[4], 其中中国科学家完成了 44个细菌基因组的测序工作。此外关于基因组学的研究报告也在逐年增加, 如表 1[5]所示。
表1:PubMed 检索到的有关基因组学和转录组学的文献1.2 细菌基因组研究策略
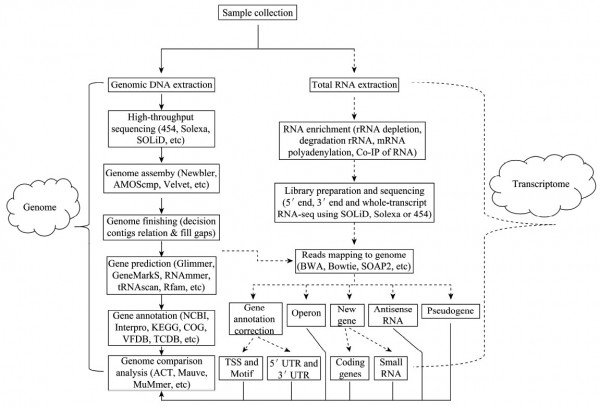
细菌基因组的研究策略主要分为DNA的提取及测序、基因组组装、基因组完成(Genomefinish-ing)、基因预测、基因注释和基因组比较分析六大部分,如图1所示。
首先是DNA的提取及测序。DNA提取时要保证DNA纯度,同时要避免DNA污染。目前主要应用的DNA测序技术是以Roche公司的454(http://www.454.com/) 、Illumina公司的Solexa(http://www.illumina.com/) 和ABI公司的SOLiD(http://www.appliedbiosystems.com.cn/) 为代表的第二代测序技术[6−8]。与第一代测序技术相比,第二代测序技术在测序成本和测序速度方面有了极大的提高。454采用焦磷酸测序法,平均读长400bp,每个循环能产生400−600Mb序列,耗时7.5h左右。经过最近的升级,454测序长度已能达到1kb,是进行未知基因组测序(Denovogenomesequencing)的理想平台。然而,454在处理单碱基重复序列(Homopolymer)时会因为荧光信号强度判断错误而引入核苷酸缺失或插入。此外,454因测序通量较小,使测序费用相对较高。Solexa采用边合成边测序的方法,SolexaGAIIx序列长度能达到100bp,每个反应能产生100Gb左右的碱基序列,耗时约9d。升级版的HiSeq2000在测序速度和测序通量上都有很大的提高,序列长度可达到120bp,每个反应能产生约600Gb的碱基序列。Solexa的优势在于测序通量大,成本低,但因为序列相对较短,会增加后继序列拼接组装等分析的难度和计算量。SOLiD采用双碱基编码原理,利用DNA连接酶在连接过程中进行测序,读长50bp,SOLiD4测序仪每个反应能产生100Gb左右的数据,耗时6−7d。SOLiD与Solexa一样,由于读长短,后继分析相对复杂;但是因为测序通量也较大,测序费用相对较低。SOLiD产生的序列是由0、1、2、3组成的Colorspace,因此数据处理时需要特殊的处理。相较基因组测序而言,SOLiD在转录组测序上具有很大的优势,因为它可以获得RNA的正负链信息,这对于转录组研究,尤其是AntisenseRNA分析,具有重要意义。最近,一款新的DNA测序方法——粒子流(Ion-torrent)半导体基因组测序方法问世(http://www.iontorrent.com/)
[9]。此方法不依赖于光信号,通过直接测知基于模板的DNA聚合酶合成反应产生的离子来获得序列信息,并且成本和通量的性价比较好。因此,测序时应该根据各个测序平台的优缺点来选择合适的测序平台。比如细菌Denovo基因组测序,可以利用454或454与Solexa相结合的测序方法,即能降低测序成本,又便于进行序列拼接组装。另外,为了方便基因组组装,我们可以适当的构建Pair-end或Mate-pair文库,通过利用配对Reads之间的关系来确定Contigs之间的关系。
第二步,基因组组装。常用的软件有Newbler[10]、AMOScmp[11]、Phred/Phrap/Consed[12−13]和Velvet[14]等,可以根据自己的数据选择合适的组装软件,也可以结合多种方法获得较好的组装结果。
第三步,基因组完成,即确定组装获得的Contigs之间的连接顺序并修补Gaps。可以按照以下几个步骤进行:首先,计算Contigs和基因组的平均Reads覆盖度,通过Contigs与基因组平均Reads覆盖度的比较,获得Unique contigs和Repeat contigs以及Repeat contigs的重复次数。这一阶段,可以过滤掉那些覆盖度明显低于基因组平均Reads覆盖度的Contigs(可能来自污染DNA序列)以及一些较短的Contigs(如长度小于500bp的Contigs,这些Contigs会在修补Gaps时被填补回去)。其次,根据Contigs之间的Reads连接数来确定Contigs之间可能的连接顺序。这一步还可以通过一些间接的方法来定位Contigs之间的连接关系:(1)通过Contigs与近缘物种基因组的比较(如MAUVE[15]和MUMmer[16]),获得Contigs之间的连接顺序;(2)利用基因在基因组上排列顺序的保守性,根据远缘物种基因组上基因的排列顺序来确定Contigs之间的连接顺序(把这些基因定位到Contigs上);(3)将Contigs与NCBI的nr/nt库进行序列比对,根据已知序列定位Contigs之间的连接顺序;(4)进行随机PCR扩增来确定Contigs之间的连接顺序;(5)利用Pair-end或者Mate-pair文库中的配对Reads获得Contigs之间的连接关系。最后,根据Contigs之间可能的连接顺序设计引物,并进行PCR扩增与测序来验证Contigs之间的连接顺序和修补Gaps,从而获得完整的基因组序列。在这一阶段,可以先确定Unique contigs之间的关系,然后再把Repeatcontigs放回对应的位置。
第四步,基因预测。常用的蛋白质编码基因预测软件有Glimmer[17]、GeneMarkS[18]和Prodigal[19],通常可以任选其中一款软件进行预测,也可以结合多个软件以获得较好的预测结果。此外,ZCURVE是基于DNA序列Zcurve理论的蛋白质编码基因识别软件,具有较高的基因起始位点预测准确性[20];GS-Finder是不依赖于rRNA序列的细菌基因组翻译起始位点识别软件,能大大提高翻译起始位点预测的准确性[21];OperonDB是比较常用的操纵子预测软件,可以用来预测共同转录的基因簇[22]。另外,非蛋白质编码基因的预测也有较成熟的软件,通常用RNAmmer[23]预测rRNA、tRNAscan-SE[24]预测tRNA以及Rfam[25]预测SmallRNA等(可以利用Splitter[26]将基因组分成较小序列,然后用Rfam寻找SmallRNA;或者下载并安装Rfamdatabase,在本地寻找SmallRNA)。
第五步,基因注释。这一步通常要整合多个数据库,如NCBI的nr库、InterPro[27]、COG[28]和KEGG[29]等,通过序列比对进行预测基因的注释。此外,还可以利用一些特定功能的软件或者数据库进行相应的分析,如用SignalP[30]预测信号肽、TMHMM[31]预测跨膜结构、ISfinder[32]预测插入序列、VFDB预测毒力因子[33]、Islander数据库查询基因组岛[34]、MobilomeFINDER[35]和IslandViewer[36]鉴定基因组岛、PAIDB预测潜在的致病岛[37]、Repeat-match预测基因组重复序列、Tandem、repeatFinder[38]寻找串联重复序列、CRISPRfinder[39]预测CRISPR序列、Phage-finder[40]寻找噬菌体序列、TCDB[41]注释膜转运蛋白、Ori-Finder[42]寻找复制起始位点、ARDB[43]鉴定和注释抗菌素抗性基因、ACLAME[44]注释可变遗传因子(Mobile genetic elements)和TADB[45]数据库搜索Type2toxin-antitoxin位点等。另外,有些基因是生物体生存不可或缺的基因,即必需基因,它们是生命的基础。DEG[46]数据库收集了一些物种的必需基因,也可以用于注释必需基因,这些必需基因是很好的抗菌药物靶基因。注释结束后,对基因注释结果进行检查,比如基因之间是否有Overlap、是否存在假基因等,可以利用Mciobial Genome Submission Check[47]程序进行检查。
最后,基因组比较分析。获得完整基因组及其注释后,通常会进行相近物种之间或同一物种不同株之间的基因组比较分析。常用的细菌基因组比较分析软件和数据库有ACT[48]、Mauve[15]、MUMmer[16]、MicrobesOnline[49]、mGenomeSubtractor[50]和xBASE[51]等。ACT(ArtemisComparisonTool),是一款进行基因组及其注释之间比较的可视化软件,支持多种输入格式(EMBL,GenBank,FASTA和GFF格式),可以用来鉴定相似序列、插入、缺失、重排等。另外,对于未注释序列,可以寻找CDS序列并进行相应的比较。目前,有两款基于ACT的网站,WebACT[52]和DoubleACT(http://www.hpa-bioinfotools.org.uk/pise/double_act.html)。 WebACT提供了已知物种的基因组比较结果,同时支持上传序列进行在线比较分析,而DoubleACT提供生成ACT可读的基因组比较文件。Mauve可以非常有效地构建多基因组比对结果,而且可以容忍基因组重排和倒置,同时Mauve会根据比对结果绘制不同基因组之间的进化树。MUMmer可以用来比较完整的或者不完整的基因组序列(如Contigs),既可以在DNA水平比较,也可以在蛋白质水平比较,而且还可用于高等真核生物基因组之间的比较。另外,ACT可以利用MUMmer的比较结果进行可视化操作。Microbes Online是一个提供原核生物比较和功能基因组分析的数据库,包含了1000多个基因组和许多物种的芯片表达数据。Microbes Online包含的模块有比较基因组浏览器、基因调控预测、系统发生搜索、代谢途径比较、操纵子预测、序列分析以及和其他微生物基因组资源的整合分析等。mGenome Subtractor是通过相近物种基因组的在线比较分析得到保守的和特异性的基因组片段,从而获得一个特定细菌的表型、环境适应和疾病相关等信息。xBASE是一个细菌基因组比较注释软件,只要提供完整或不完整的Fasta格式基因组序列,就能获得基因组注释结果。xBASE特别适合那些有参考基因组的基因组序列。另外,xBASE开发了针对第二代测序数据的xBASE-NG模块,可以进行SNP分析、新序列挖掘和基因组注释等。
通过细菌基因组比较分析有助于阐明微生物的许多特性(如耐高温、耐盐、降解塑料和抗药性等),许多研究成果可应用于工业生产(如发酵)、环境治理(如分解石油)以及医药(如抗生素)等方面。当前对致病菌的研究主要集中于毒力因子、致病岛、耐药基因、耐药机制以及与寄主的关系等,通过比较可以发现或预测致病菌的致病相关基因,为疾病的诊断、药靶的寻找和疫苗或抗生素的研制提供理论支持。通过基因组比较还可以研究进化史、构建生物进化树。CVTree[53]是一个不基于序列比对的系统发生树分析工具。它是利用组成向量法(Composition vector)构建全基因组的系统发生树,这样即避免了因为基因选择而带来的系统发生树的可变性,又避免了不同长度和内容基因之间的序列比对。
2 细菌转录组学研究
2.1 细菌转录组学简介
细菌转录组学是从RNA水平研究基因表达的情况。目前细菌转录组学主要应用于基因注释校正、基因表达、操纵子鉴定、转录起始位点(TSS)鉴定、新基因鉴定、SmallRNA分析等内容。此外,通过细菌转录组比较分析,研究细菌在不同环境、宿主等情况下的基因表达变化,从而阐述宿主、环境对细菌的影响、细菌致病机制等。目前转录组学的研究也在逐年增加,如表1所示,但是相对于基因组学来说,细菌转录组学尚处于发展阶段。
2.2 细菌转录组研究策略
细菌转录组的研究策略主要包括总 RNA的提取和目的RNA的富集、RNA建库及测序、Reads mapping和后继分析等(图 1)。
图 1 基于第二代测序技术的细菌基因组与转录组研究策略图
首先进行总RNA的提取和目的RNA的富集。细菌mRNA的半衰期很短,又极易降解,因此防止其降解是十分重要的。仪器用具都要经过严格的处理,最好是RNA实验专用;材料一定要新鲜,切忌使用反复冻融的材料;整个RNA提取过程中动作应迅速,并需要加入RNA酶抑制剂。细菌mRNA一般只占总RNA的1%−5%,因此,总RNA提取完成后一般要进行mRNA的富集,主要有以下4种方法[54]:(1)rRNA捕获法。根据16SrRNA和23SrRNA保守区域序列设计探针并将探针固定在磁珠上,利用探针和rRNA杂交去除rRNA。在一般情况下该方法可以去掉大部分rRNA,但效果因不同的基因组而异。(2)降解rRNA和tRNA法。在原核生物中rRNA和tRNA等加工过的RNA含有5′单磷酸(5′P)而mRNA含有5′三磷酸(5′PPP),利用特异性降解5′单磷酸RNA分子的核酸外切酶(5′→3′)降解rRNA和tRNA。该方法一般仅可以去掉细菌10%−20%的rRNA。(3)多腺苷酸mRNA选择法。利用大肠杆菌polyA聚合酶能够在mRNA末尾添加polyA而不能在rRNA末尾添加polyA的特性,在mRNA末尾加上polyA,然后利用Oligo(dT)探针捕获处理后的mRNA。该方法简单快速,但mRNA中会有初级转录本的加工产物和未翻译的mRNA降解产物。(4)抗体法。通过抗体捕获与特定蛋白质相互作用的RNA,比如SmallRNA可以和Hfq蛋白质相互作用,可以利用这一特性采取免疫共沉淀的方法获得SmallRNA。该方法特异性好,效率高,可用于SmallRNA的分析。4种mRNA富集方法各有特点,rRNA捕获法需要预先知道rRNA序列;多腺苷酸mRNA选择法依赖polyA聚合酶;抗体法比较适合SmallRNA等的分析;而降解rRNA和tRNA法也依赖特异性核酸外切酶。
第二步,选择合适的建库方法和测序平台进行测序。测序文库包括5′末端测序文库、3′末端测序文库、完整转录本测序文库等,5′末端测序文库和3′末端测序文库适合UTR区和操纵子的研究,而完整转录本测序文库适合进行不同样本或者不同时期转录本之间表达量的比较分析以及新基因鉴定等。测序平台主要有SOLiD、Solexa和454三种。SOLiD具有链特异性,适合研究SmallRNA、发现新基因等,Solexa测序成本较低,而454适合进行基因组序列未知物种的转录组分析。大家要根据研究对象和研究目的选择合适的建库方法和测序平台,比如鉴定转录起始位点应该构建5′末端测序文库和采用链特异性测序方法(SOLiD),而研究操纵子要构建完整转录本测序文库。需要说明的是链特异性测序方法越来越受欢迎。此方法可以明确转录本的方向、解决正负链基因重叠问题和提高基因(包括操纵子)注释的准确性,特别适合鉴定转录起点、反义RNA和发现新基因。目前链特异性测序方法主要分为两类,一类是在mRNA的两端分别连接不同的接头,使5'和3'易于区分便于寻找转录模板;另一类是对cDNA的一条链进行化学修饰产生标记,如用重亚硫酸盐处理RNA或者利用dUTP来合成cDNA的第二条链[55]。
第三步,Reads mapping和后继分析。首先将Reads进行Mapping,从而获得Reads在基因组上的位置,常用的Mapping软件有BWA[56]、Bowtie[57]、SOAP2[58]等。其次,根据Reads mapping结果,进行后继分析。TSS鉴定:根据基因组上的Reads coverage来鉴定转录起始位点;5′UTR和3′UTR鉴定:鉴定编码基因中转录但不翻译的区域,即5′UTR和3′UTR;Operon鉴定:根据TSS、Reads coverage等鉴定Operon(也就是细菌中的转录单元);新基因鉴定:找出之前没有注释但是表达的区域,并根据是否存在ORF区分为蛋白质编码基因(Codinggene)和非蛋白质编码基因(Small RNA gene);AntisenseRNA鉴定:根据SmallRNA与其他基因的位置关系确定是否是AntisenseRNA;Pseudogenes分析:比如研究假基因的表达情况;保守结构域的鉴定:利用MEME[59]等软件鉴定保守结构域;ncRNA预测和鉴定:可以利用sRNAFinder[60]、nocoRNAc[61]等软件进行预测,也可以通过与Rfam database比较来预测SmallRNA[25]。另外,对那些比较重要的或者感兴趣的基因,可以通过Real-timePCR来验证RNA-seq的结果。此外,为了方便科学家直观地了解细菌基因组及转录组图谱,生物信息学家开发了许多基因组可视化软件,比如Artemis[62]和Integrated GenomeBrowser(IGB)[63]等。
3 细菌基因组学与转录组学研究的机遇与挑战
3.1 细菌基因组学研究机遇与挑战
伴随着国际人类基因组计划的进行,细菌基因组学也获得了快速的发展。随着第二代测序技术的出现,细菌基因组学研究迎来了第二次高峰。目前,细菌基因组测序多采用454或者454加Solexa的方式,不但加快了数据产出,而且有利于基因组拼接。获得细菌完整基因组后,就要进行细菌基因组的分析和注释。常用的细菌基因组分析和注释工具如上文所述,我们也可以参考PauStothard等的综述[64]。细菌的研究现在多集中于模式细菌(如大肠杆菌)和致病菌,主要研究细菌的毒素、运动、粘附和生物膜形成、分泌系统、细胞表面蛋白、代谢及应激反应等[65]。此外,通过相似物种基因组比较分析来揭示病原菌相关遗传线索[66],也是细菌基因组学研究的一个重要方向。
虽然第二代测序技术给细菌基因组学研究带来了新的机遇,但是也带来了一些新的问题,比如基于焦磷酸测序的454测序方法常在单碱基重复序列区域出现插入/缺失,会导致注释基因的移码突变;Solexa测序法获得的Reads长度较短而影响拼接结果;细菌基因组组装及分析流程较繁琐,亟待新的方法或高度整合型的处理流程来加快分析过程等。
3.2 细菌转录组学研究机遇与挑战
转录组学是研究生物体基因表达和RNA调控的有力工具。伴随着第二代测序技术的出现,在真核生物中进行了大量基于高通量测序技术的转录组学研究[67]。然而,由于科学家普遍认为细菌转录组比较简单、细菌mRNA不易富集等原因,细菌转录组学被大大忽视。随着测序能力的大幅度提高和一些特定细菌mRNA富集方法的出现[68−71],细菌转录组越来越受到关注。
虽然细菌转录组学领域的研究目前还处于发展阶段,但是它提供了在基因组水平上研究细菌RNA调控机制的重要手段。通过深度测序的转录组研究,人们发现许多调控元件(如SmallRNA、Riboswitches和Cis-antisense调控因子等)[72−76]参与了原核生物的生理和病理过程。此外,有效的转录组分析可以改善基因组的注释,转录组分析将来可能会成为基因组注释的一个标准构件。
目前原核转录组研究表明原核生物的调控复杂性和冗余性远远超过了最初的预料[54]。进一步的原核转录组研究可能揭示SmallRNA调控网络、顺式作用元件(Cis-acting element)、环境依赖性功能开(Riboswitch)和长反义转录本等的重要作用。转录组学方法的局限性在于它们需要成千上万的细胞作为材料,这就无法确定正义转录本和反义转录本是互相排斥的还是可以同时转录的。因此,单细胞转录组研究是转录组研究的新方向,同时单细胞转录组将促进非培养细菌的研究和更精确地研究不同时间、不同环境下转录组的变化。此外,随着转录组学研究的深入,便捷的转录组学分析流程及软件会大大促进细菌转录组学的发展。
4 总结
细菌基因组学和转录组学的发展,不但可以用来研究生命形成、生物进化、基础代谢、疾病发生、药物靶点等,同时也可以相互促进各自学科的发展。比如基因组序列为转录组数据注释提供了参考,同时转录组数据可以用来校正基因组注释信息、发现新基因和促进功能基因组学的发展。细菌基因组学和转录组学研究策略为大多数细菌研究提供了一个相对完整的研究路线,同时也会促进单个实验室或者研究组进行细菌基因组及转录组的研究。此外,细菌转录组学还需要科学家们进一步的深入研究,并把细菌转录组分析变成为细菌的常规分析。
参考文献
[1] Fleischmann RD, Adams MD, White O, et al.Whole-genome random sequencing and assembly ofHaemophilus influenzae Rd[J]. Science, 1995, 269(5223):496−512.
[2] Bult CJ, White O, Olsen GJ, et al. Complete genome se- quence of the methanogenic archaeon, Methanococcus jannaschii[J]. Science, 1996, 273(5278): 1058−1073.
[3] Blattner FR, Plunkett G 3rd, Bloch CA, et al. The com- plete genome sequence of Escherichia coli K-12[J]. Sci- ence, 1997, 277(5331): 1453−1462.
[4] NCBI: http: //www. ncbi. nlm. nih. gov/genomes/lproks.Cgi.
[5] Sayers EW, Barrett T, Benson DA, et al. Database re- sources of the National Center for Biotechnology Infor- mation[J]. Nucleic Acids Res, 2009, 37(Database issue): D5−D15.
[6] Margulies M, Egholm M, Altman WE, et al. Genome se- quencing in microfabricated high-density picolitre reac- tors[J]. Nature, 2005, 437(7057): 376−380.
[7] Turcatti G, Romieu A, Fedurco M, et al. A new class of cleavable fluorescent nucleotides: synthesis and optimiza- tion as reversible terminators for DNA sequencing by synthesis[J]. Nucleic Acids Res, 2008, 36(4): e25.
[8] Shendure J, Porreca GJ, Reppas NB, et al. Accurate mul- tiplex polony sequencing of an evolved bacterial ge- nome[J]. Science, 2005, 309(5741): 1728−1732.
[9] Rothberg JM, Hinz W, Rearick TM, et al. An integrated semiconductor device enabling non-optical genome se- quencing[J]. Nature, 2011, 475(7356): 348−352.
[10] 454 sequencing: http://454. com.
[11] Pop M, Phillippy A, Delcher AL, et al. Comparative ge- nome assembly[J]. Briefings in Bioinformatics, 2004,5(3): 237−248.
[12] Ewing B, Green P. Base-calling of automated sequencer traces using phred. II. Error probabilities[J]. Genome Re- search, 1998, 8(3): 186−194.
[13] Gordon D. Viewing and editing assembled sequences us- ing Consed[J]. Curr Protoc Bioinformatics, 2003, Chapter11.
[14] Zerbino DR, Birney E. Velvet: Algorithms for de novo short read assembly using de Bruijn graphs[J]. Genome Research, 2008, 18(5): 821−829.
[15] Darling ACE, Mau B, Blattner FR, et al. Mauve: multiple alignment of conserved genomic sequence with rear- rangements[J]. Genome Research, 2004, 14(7): 1394−1403.
[16] Kurtz S, Phillippy A, Delcher AL, et al. Versatile and open software for comparing large genomes[J]. Genome Biol-ogy, 2004, 5(2): R12.
[17] Delcher AL, Bratke KA, Powers EC, et al. Identifying bacterial genes and endosymbiont DNA with Glimmer[J]. Bioinformatics, 2007, 23(6): 673−679.
[18] Besemer J, Lomsadze A, Borodovsky M. GeneMarkS: a self-training method for prediction of gene starts in mi- crobial genomes. Implications for finding sequence motifs in regulatory regions[J]. Nucleic Acids Research, 2001,29(12): 2607−2618.
[19] Hyatt D, Chen GL, Locascio PF, et al. Prodigal: prokary- otic gene recognition and translation initiation site identi- fication[J]. BMC Bioinformatics, 2010, 11(1): 119.
[20] Guo FB, Ou HY, Zhang CT. ZCURVE: a new system for recognizing protein-coding genes in bacterial and archaeal genomes[J]. Nucleic Acids Res, 2003, 31(6): 1780−1789.
[21] Ou HY, Guo FB, Zhang CT. GS-Finder: a program to find bacterial gene start sites with a self-training method[J]. Int J Biochem Cell Biol, 2004, 36(3): 535−544.
[22] Ermolaeva MD, White O, Salzberg SL. Prediction of op- erons in microbial genomes[J]. Nucleic Acids Res, 2001,29(5): 1216−1221.
[23] Lagesen K, Hallin P, Rødland EA, et al. RNAmmer: con- sistent and rapid annotation of ribosomal RNA genes[J]. Nucleic Acids Research, 2007, 35(9): 3100−3108.
[24] Schattner P, Brooks AN, Lowe TM. The tRNAscan-SE, snoscan and snoGPS web servers for the detection of tRNAs and snoRNAs[J]. Nucleic Acids Research, 2005,33(Issue suppl 2):W686−W689.
[25] Gardner PP, Daub J, Tate JG, et al. Rfam: updates to theRNA families database[J]. Nucleic Acids Research, 2009,37(Database issue): D136−D140.
[26] splitter:http://emboss.bioinformatics.nl/cgi−bin/emboss/splitter.
[27] Hunter S, Apweiler R, Attwood TK, et al. InterPro: the integrative protein signature database[J]. Nucleic Acids Research, 2009, 37(Database issue): D211−D215.
[28] Tatusov RL, Koonin EV, Lipman DJ. A genomic perspec- tive on protein families[J]. Science, 1997, 278(5338):631−637.
[29] KEGG: http://www.genome.jp/kegg/.
[30] Bendtsen JD, Nielsen H, von Heijne G, et al. Improved prediction of signal peptides: SignalP 3. 0[J]. Journal of Molecular Biology, 2004, 340(4): 783−795.
[31] Krogh A, Larsson B, von Heijne G, et al. Predicting transmembrane protein topology with a hidden Markov model: application to complete genomes[J]. Journal of Molecular Biology, 2001, 305(3): 567−580.
[32] Siguier P, Perochon J, Lestrade L, et al. ISfinder: the ref- erence centre for bacterial insertion sequences[J]. NucleicAcids Research, 2006, 34(Database issue): D32−D36.
[33] Yang J, Chen LH, Sun LL, et al. VFDB 2008 release: an enhanced web-based resource for comparative pathoge- nomics[J]. Nucleic Acids Research, 2008, 36(Database issue): D539−D542.
[34] Mantri Y, Williams KP. Islander: a database of integrative islands in prokaryotic genomes, the associated integrases and their DNA site specificities[J]. Nucleic Acids Res,2004, 32(Database issue): D55−D58.
[35] Ou HY, He XY, Harrison EM, et al. MobilomeFINDER: web-based tools for in silico and experimental discovery of bacterial genomic islands[J]. Nucleic Acids Res, 2007,35(Web Server issue): W97−W104.
[36] Langille MGI, Brinkman FSL. IslandViewer: an integrated interface for computational identification and visualiza- tion of genomic islands[J]. Bioinformatics, 2009, 25(5):664−665.
[37] Yoon SH, Park YK, Lee S, et al. Towards pathogenomics: a web-based resource for pathogenicity islands[J]. Nucleic Acids Res, 2007, 35(Database issue): D395−D400.
[38] Benson G. Tandem repeats finder: a program to analyzeDNA sequences[J]. Nucleic Acids Research, 1999, 27(2):573−580.
[39] Grissa I, Vergnaud G, Pourcel C. CRISPRFinder: a web tool to identify clustered regularly interspaced short pal- indromic repeats[J]. Nucleic Acids Research, 2007,35(Web Server issue): W52−W57.
[40] Fouts DE. Phage_Finder: Automated identification and classification of prophage regions in complete bacterial genome sequences[J]. Nucleic Acids Research, 2006,34(20): 5839−5851.
[41] Saier MH Jr, Yen MR, Noto K, et al. The Transporter Classification Database: recent advances[J]. Nucleic Ac- ids Research, 2009, 37(Database issue): D274−D278.
[42] Gao F, Zhang CT. Ori-Finder: a web-based system for finding oriCs in unannotated bacterial genomes[J]. BMC Bioinformatics, 2008, 9: 79.
[43] Liu B, Pop M. ARDB-Antibiotic Resistance Genes Data- base[J]. Nucleic Acids Res, 2009, 37(Database issue): D443−447.
[44] Leplae R, Lima-Mendez G, Toussaint A. ACLAME: aCLAssification of Mobile genetic Elements, update2010[J]. Nucleic Acids Res, 2010, 38(Database issue): D57−D61.
[45] Shao YC, Harrison EM, Bi DX, et al. TADB: a web-based resource for Type 2 toxin-antitoxin loci in bacteria and archaea[J]. Nucleic Acids Res, 2011, 39(Database issue): D606−D611.
[46] Zhang R, Lin Y. DEG 5. 0, a database of essential genes in both prokaryotes and eukaryotes[J]. Nucleic Acids Res,2009, 37(Database issue): D455−D458.
[47] Microbial Genome Submission Check: http://www.ncbi.nlm.nih.gov/genomes/frameshifts/frameshifts.cgi.
[48] Carver TJ, Rutherford KM, Berriman M, et al. ACT: theArtemis Comparison Tool[J]. Bioinformatics, 2005,21(16): 3422−3423.
[49] Dehal PS, Joachimiak MP, Price MN, et al. Microbe- sOnline: an integrated portal for comparative and func- tional genomics[J]. Nucleic Acids Res, 2010, 38(Database issue): D396−D400.
[50] Shao YC, He XY, Harrison EM, et al. mGenomeSubtrac- tor: a web-based tool for parallel in silico subtractive hy- bridization analysis of multiple bacterial genomes[J]. Nu- cleic Acids Res, 2010, 38(Web Server issue): W194−W200.
[51] Chaudhuri RR, Loman NJ, Snyder LAS, et al. xBASE2: a comprehensive resource for comparative bacterial ge- nomics[J]. Nucleic Acids Res, 2008, 36(Database issue): D543−D546.
[52] Abbott JC, Aanensen DM, Rutherford K, et al. We- bACT-an online companion for the Artemis Comparison Tool[J]. Bioinformatics, 2005, 21(18): 3665−3666.
[53] Xu Z, Hao BL. CVTree update: a newly designed phy- logenetic study platform using composition vectors and whole genomes[J]. Nucleic Acids Res, 2009, 37(Web Server issue): W174−W178.
[54] Sorek R, Cossart P. Prokaryotic transcriptomics: a new view on regulation, physiology and pathogenicity[J]. Na- ture Reviews Genetics, 2010, 11(1): 9−16.
[55] Levin JZ, Yassour M, Adiconis X, et al. Comprehensive comparative analysis of strand-specific RNA sequencing methods[J]. Nat Methods, 2010, 7(9): 709−715.
[56] Li H, Durbin R. Fast and accurate short read alignment with Burrows-Wheeler transform[J]. Bioinformatics,2009, 25(14): 1754−1760.
[57] Langmead B, Trapnell C, Pop M, et al. Ultrafast and memory-efficient alignment of short DNA sequences to the human genome[J]. Genome Biology, 2009, 10(3): R25.
[58] Li RQ, Yu C, Li YR, et al. SOAP2: an improved ultrafast tool for short read alignment[J]. Bioinformatics, 2009,25(15): 1966−1967.
[59] Bailey TL, Elkan C. Fitting a mixture model by expecta- tion maximization to discover motifs in biopolymers // Proceedings of the Second International Conference on Intelligent Systems for Molecular Biology. 1994, 2:28−36.
[60] Tjaden B. Prediction of small, noncoding RNAs in bacte- ria using heterogeneous data[J]. J Math Biol, 2008,56(1/2): 183−200.
[61] Herbig A, Nieselt K. nocoRNAc: characterization of non-coding RNAs in prokaryotes[J]. BMC Bioinformatics,2011, 12: 40.
[62] Rutherford K, Parkhill J, Crook J, et al. Artemis: sequence visualization and annotation[J]. Bioinformatics, 2000,16(10): 944−945.
[63] Nicol JW, Helt GA, Blanchard SG Jr, et al. The Integrated Genome Browser: free software for distribution and ex- ploration of genome-scale datasets[J]. Bioinformatics,2009, 25(20): 2730−2731.
[64] Stothard P, Wishart DS. Automated bacterial genome analysis and annotation[J]. Current Opinion in Microbiology, 2006, 9(5): 505−510.
[65] Duchaud E, Boussaha M, Loux V, et al. Complete genome sequence of the fish pathogen Flavobacterium psychro- philum[J]. Nature Biotechnology, 2007, 25(7): 763−769.
[66] Guzmán E, Romeu A, Garcia-Vallve S. Completely se- quenced genomes of pathogenic bacteria: a review[J]. Enferm Infecc Microbiol Clin, 2008, 26(2): 88−98.
[67] Wang Z, Gerstein M, Snyder M. RNA-Seq: a revolution- ary tool for transcriptomics[J]. Nature Reviews Genetics,2009, 10(1): 57−63.
[68] Yoder-Himes DR, Chain PSG, Zhu Y, et al. Mapping the Burkholderia cenocepacia niche response via high-throughput sequencing[J]. Proceedings of the Na- tional Academy of Sciences of the United States of Amer- ica, 2009, 106(10): 3976−3981.
[69] Sharma CM, Hoffmann S, Darfeuille F, et al. The primary transcriptome of the major human pathogen Helicobacter pylori[J]. Nature, 2010, 464(7286): 250−255.
[70] Frias-Lopez J, Shi YM, Tyson GW, et al. Microbial com- munity gene expression in ocean surface waters[J]. Pro- ceedings of the National Academy of Sciences of the United States of America, 2008, 105(10): 3805−3810.
[71] Sittka A, Lucchini S, Papenfort K, et al. Deep sequencing analysis of small noncoding RNA and mRNA targets of the global post-transcriptional regulator, Hfq[J]. PLoS Genetics, 2008, 4(8): e1000163.
[72] Perkins TT, Kingsley RA, Fookes MC, et al. A strand-specific RNA-Seq analysis of the transcriptome of the typhoid bacillus Salmonella typhi[J]. PLoS Genet,2009, 5(7): e1000569.
[73] Wurtzel O, Sapra R, Chen F, et al. A single-base resolution map of an archaeal transcriptome[J]. Genome Res, 20(1):133−141.
[74] Güell M, van Noort V, Yus E, et al. Transcriptome com- plexity in a genome-reduced bacterium[J]. Science, 2009,326(5957): 1268−1271.
[75] Toledo-Arana A, Dussurget O, Nikitas G, et al. The Lis- teria transcriptional landscape from saprophytism to viru- lence[J]. Nature, 2009, 459(7249): 950−956.
[76] Passalacqua KD, Varadarajan A, Ondov BD, et al. Struc- ture and complexity of a bacterial transcriptome[J]. JBacteriol, 2009, 191(10): 3203−3211.